高中学考化学必背知识点
有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。其它物质的颜色见会考手册的颜色表。有刺激性气味的气体:HF、HCl、HBr、HI、NHSONOFClBr2(g);有臭鸡蛋气味的气体:H2S。
点:『1』电荷:用电子式表示离子键形成的物质的结构需标出阳离子和阴离子的电 荷;而表示共价键形成的物质的结构不能标电荷。『2』[](方括号):离子键形成的物 质中的阴离子需用方括号括起来,而共价键形成的物质中不能用方括号。
天然气、沼气、坑气(主要成分):CH4 水煤气:CO和H2 硫酸亚铁铵(淡蓝绿色):Fe (NH4)2 (SO4)2 溶于水后呈淡绿色 光化学烟雾:NO2在光照下产生的一种有毒气体 王水:浓HNO3:浓HCl按体积比1:3混合而成。 铝热剂:Al + Fe2O3或其它氧化物。
化学合格考的知识点归纳 SO2的性质:强的还原性、漂白性、弱的氧化性、酸性氧化物。 SO2通入氯化钡、氯化钙溶液都没有沉淀。但是通入硝酸钡溶液有沉淀。因为SO2在水溶液中生成亚硫酸,亚硫酸电离出氢离子与硝酸根构成硝酸,可以氧化SO2氧化成硫酸根离子,生成硫酸钡沉淀。
高中化学学习特别重视基础,包括基础的元素周期律,化学方程式、化学反应的实质等内容知识都要记得滚瓜烂熟,因为这是解题最基本的保障。高中化学必考知识点 (一)纯净物: 重水D2O;超重水T2O;蒸馏水H2O;双氧水H2O2;水银Hg;水晶SiO2。
高三化学合格考的知识点归纳 有机物的不饱和度 不饱和度又称缺氢指数,是有机物分子不饱和程度的量化标志,用希腊字母Ω表示。规定烷烃的不饱和度是0(所有的原子均已饱和)。不饱和度是计算有机物的分子式和推导有机物的结构式的相当有用的工具。

高二化学会考知识点总结归纳
高二化学会考知识点总结归纳 物质结构理论 用原子半径、元素化合价周期性变化比较不同元素原子或离子半径大小。用同周期、同主族元素金属性和非金属性递变规律判断具体物质的酸碱性强弱或气态氢化物的稳定性或对应离子的氧化性和还原性的强弱。
中和热概念:在稀溶液中,酸跟碱发_中和反应__成1molH2O,这时的反应热叫中和热。强酸与强碱的中和反应其实质是H+和OH-反应,其热化学_程式为:H+(aq)+OH-(aq)=H2O(l)ΔH=-53kJ/mol氧化还原反应是有电子转移(或者化合价升降)的反应。本质是电子转移(包括电子的得失和偏移)。
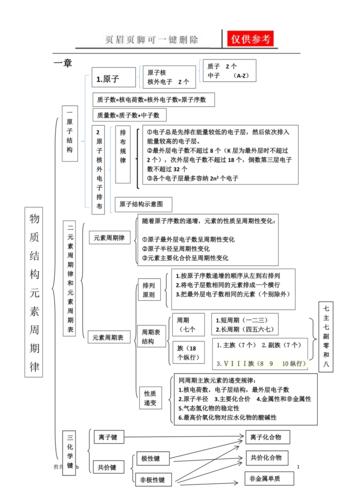
高二化学学业水平测试知识点:基本理论 掌握一图(原子结构示意图)、五式(分子式、结构式、结构简式、电子式、最简式)、六方程(化学方程式、电离方程式、水解方程式、离子方程式、电极方程式、热化学方程式)的正确书写。
高中化学会考知识点有:羧酸的同分异构现象:羧酸的同分异构现象较普遍,羧酸既存在同类的同分异构体,也存在羧酸与酯的同分异构体。
化学必考必背的知识点有化合阶、氧化还原反应、金属活动性周期表、离子反应、放热反应和吸热反应、各物理量之间的转化公式和推论、配置一定物质的量浓度的溶液、钠的原子结构及性质。

高中化学必背重要知识
〖Ⅰ〗、高中化学会考必背知识点:物质结构理论 、化学反应速率和化学平衡理论 、化学实验安全等。物质结构理论 用原子半径、元素化合价周期性变化比较不同元素原子或离子半径大小。
〖Ⅱ〗、高考化学必考基本知识掌握一图(原子结构示意图)、五式(分子式、结构式、结构简式、电子式、最简式)、六方程(化学方程式、电离方程式、水解方程式、离子方程式、电极方程式、热化学方程式)的正确书写。
〖Ⅲ〗、氧化还原反应的特征:有元素化合价升降。『3』判断氧化还原反应的依据:凡是有元素化合价升降或有电子的转移的化学反应都属于氧化还原反应。

物理化学现象有哪些?
〖Ⅰ〗、生活中的物理化学现象 物理现象: 『1』坐在快速行驶的车上,在转弯的时候,会感觉向外甩,这是离心现象。 『2』指甲剪、剪刀、镊子的工作原理,是杠杆。
〖Ⅱ〗、生石灰化学名称叫氧化钙,加水后变成熟石灰,化学名称叫氢氧化钙,也就是平常所说的白灰。把生石灰变成熟石灰的过程叫做“消化”这是一个放热反应: 不安定的卫生球说起卫生球,大家一定很熟悉,经常用它来杀死衣箱中的蛀虫。
〖Ⅲ〗、我们的生活中存在许多化学现象,以下是一些常见的例子: 燃烧:燃烧是指物质与氧气发生化学反应产生能量、释放光和产生新的物质。例如,蜡烛燃烧时蜡燃料与空气中的氧气反应,产生二氧化碳和水蒸气,释放出光和热能。 腐蚀:腐蚀是指物质与环境中的其他物质发生化学反应导致物质的损坏或破坏。
有没有简短的化学小常识
氨水(乙醇溶液一样)的密度小于1,浓度越大,密度越小,硫酸的密度大于1,浓度越大,密度越大,98%的浓硫酸的密度为:84g/cm3。
化学小常识一:水的密度 水的密度是每立方厘米1克,这就是为什么在水中漂浮的物体比水轻。化学小常识二:醋的酸性 醋是一种常用的食品调味品,它的主要成分是乙酸,因此味道带有酸味。化学小常识三:牛奶的pH值 一般牛奶的pH值约为5-7,属于微酸性食品。
禁止穿拖鞋、高跟鞋、背心、短裤(裙)进入实验室。1禁止将手机带入实验室,一旦发现实验老师有权进行处理。
高中常考的化学常识
〖Ⅰ〗、.氢离子的氧化性属于酸的通性,即任何可溶性酸均有氧化性。 2.不是所有的物质都有化学键结合。如:稀有气体。 3.不是所有的正四面体结构的物质键角为109。28, 如:白磷。 5.电解质溶液导电,电解抛光,等都是化学变化。
〖Ⅱ〗、高中化学基础知识点总结 离子方程式书写的基本规律要求 『1』合事实:离子反应要符合客观事实,不可臆造产物及反应。『2』式正确:化学式与离子符号使用正确合理。『3』号实际:“=”“ ”“→”“↑”“↓”等符号符合实际。
〖Ⅲ〗、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。其它物质的颜色见会考手册的颜色表。有刺激性气味的气体:HF、HCl、HBr、HI、NHSONOFClBr2(g);有臭鸡蛋气味的气体:H2S。
〖Ⅳ〗、无机部分包括框图题:突破口(特征反应、特殊现象、特殊颜色、重复出现的物质、特殊反应条件、特殊量的关系);推断题:物质结构(核外电子排布、晶体性质)、典型物质的化学性质等;方程式的书写:审题(离子方程式或化学方程式)、充分利用信息写出并配平(先氧化还原,再电荷守恒,后质量守恒)。

有关化学的常识(高中&初中)
〖Ⅰ〗、有色气体:F2(淡黄绿色)、Cl2(黄绿色)、Br2(g)(红棕色)、I2(g)(紫红色)、NO2(红棕色)、O3(淡蓝色),其余均为无色气体。其它物质的颜色见会考手册的颜色表。有刺激性气味的气体:HF、HCl、HBr、HI、NHSONOFClBr2(g);有臭鸡蛋气味的气体:H2S。
〖Ⅱ〗、高中化学实验基本操作知识点 仪器的洗涤 玻璃仪器洗净的标准是:内壁上附着的水膜均匀,既不聚成水滴,也不成股流下。试纸的使用 常用的有红色石蕊试纸、蓝色石蕊试纸、pH试纸、淀粉碘化钾试纸和品红试纸等。
〖Ⅲ〗、高中化学会考必背知识点:物质结构理论 、化学反应速率和化学平衡理论 、化学实验安全等。物质结构理论 用原子半径、元素化合价周期性变化比较不同元素原子或离子半径大小。
〖Ⅳ〗、② 熟悉常见元素的化合价。能根据化合价正确书写化学式(分子式),或根据化学式判断元素的化合价。③ 掌握原子结构示意图、电子式、 分子式、结构式和结构简式等表示方法。④ 了解相对原子质量、相对分子质量的定义,并能进行有关计算。⑤ 理解质量守恒定律。
〖Ⅴ〗、⒈分子是能够独立存在并保持物质化学性质的一种微粒。⒉原子是化学变化中的最小微粒。确切地说,在化学反应中原子核不变,只有核外电子发生变化。⒊离子是指带电荷的原子或原子团。⒋同周期的元素中,原子最外层电子越少,越容易失去电子,还原性越强。
初三化学学好的窍门
初三化学学好的窍门如下:建立扎实的基础:化学是一门需要扎实基础的学科,因此在学习化学时,应该注重基础知识的学习和掌握。这包括化学反应、化学式、化学方程式、物质性质等方面的知识。只有建立了坚实的基础,才能更好地理解和应用后续的化学知识。
吃透课本,联系实际 以课本为主线,认真吃透课本,这是学好化学的根本。为此,必须善于阅读课本,做到课前预读、课后细读、经常选读等,既重视主要内容,也不忽视小字部分、一些图表、资料及选学内容。中学化学内容与生活、生产联系紧密。
化学本身有着独特“语言系统”──化学用语。如:元素符号、化学式、化学方程式等,对这些化学用语的熟练掌握是化学入门的首要任务,而其中大多数必须记忆;一些物质的性质、制取、用途等也必须记忆才能掌握它们的规律。以上是小编总结的学好化学的窍门,希望能帮到你。
“记”——化学在同学们脑中;“记’即记忆。与数学、物理相比较,“记忆”对化学显得尤为重要,它是学化学的最基本方法,离开了“记忆”谈其他就成为一句空话。这是由于: (l)化学本身有着独特“语言系统”──化学用语。
关于中学化学常识和中学化学知识概念图的介绍到此就结束了,不知道你从中找到你需要的信息了吗 ?如果你还想了解更多这方面的信息,记得收藏关注本站。



发表评论